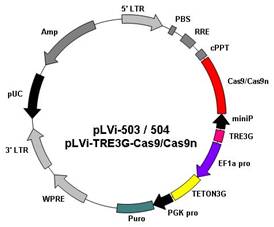
(一)诱导型Cas9/Cas9n过表达慢病毒载体 (pLVi-503,pLVi-504)
载体特点:
u 使用改良的四环素反应元件(TRE3G)和反义四环素转录激活子(TETON3G)并反向克隆到同一慢病毒载体,显著提高了诱导效果,并降低了本底,在非诱导条件下几乎检测不到“泄漏”的人源化Cas9蛋白;
u 加入药物Dox时,TETON3G与其结合后发生构象改变并结合到TRE3G位点,从而促使miniCMV启动子控制下的Cas9或者Cas9n的表达;
u 含有嘌呤霉素(puromycin)抗性筛选基因,可筛选稳定表达细胞系;
u 既可用瞬时转染,也可包装成慢病毒后感染细胞;
u 与第四代慢病毒包装质粒匹配,可制备高滴度慢病毒颗粒。
载体图谱:
为什么要选择诱导型Cas9表达体系?
利用Cas9技术可以进行高通量筛选,现有的做法是在Cas9稳转细胞系上进行操作。研究表明,Cas9的持续表达对细胞会产生一定的毒性,因此我们开发了诱导型Cas9过表达慢病毒载体,可以方便地构建稳转细胞系。当对细胞转染过表达sgRNA的载体或者体外合成的sgRNA时,加Dox便可诱导Cas9表达并启动对靶DNA的编辑,一旦剪切筛选任务结束,更换为不含Dox的培养液,便可有效避免由于Cas9持续表达对细胞造成的各种毒副作用。
(二)sgRNA过表达慢病毒载体
1. pLVc-502 (pLVc/U6.sgRNA-copGFP-Puro):
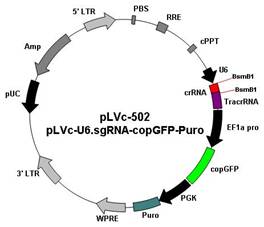
载体特点:
u 使用人U6启动子表达sgRNA序列;
u 用BsmB1酶切载体,与crRNA插入片段连接;
u 含有copGFP标记基因,可以实时跟踪转染效率;
u 含有嘌呤霉素(puromycin)抗性筛选基因,可筛选稳定表达细胞系;
u 既可用于瞬时转染,也可包装成慢病毒后感染细胞;
u 设计crRNA插入片段的引物结构为
上游引物: 5`-ACCG NNNN NNNNN NNNNN NNNNN-3’
下游引物: 3`-nnnn nnnnn nnnnn nnnnn CAAA-5’
2. pLVc-505 (pLVc/U6.sgRNA-Bla-P2A-EGFP):
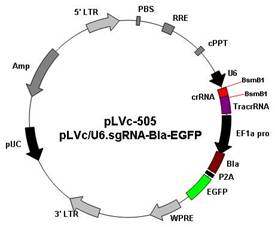
载体特点:
u 使用人U6启动子表达sgRNA序列;
u 用BsmB1酶切载体,与crRNA插入片段连接;
u 含有EGFP标记基因,可以实时跟踪转染效率;
u 含有杀稻瘟菌素(Blasticidin)抗性筛选基因,可筛选稳定表达细胞系;
u 既可用瞬时转染,也可包装成慢病毒后感染细胞;
u 设计crRNA插入片段的引物结构为
上游引物: 5`-ACCG NNNN NNNNN NNNNN NNNNN-3’
下游引物: 3`-nnnn nnnnn nnnnn nnnnn CAAA-5’
(三)sgRNA/Cas9共表达载体
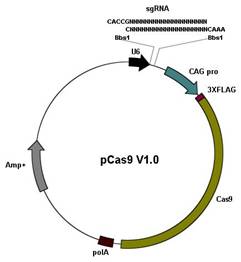
1. 常规质粒载体 (pCas9 V1.0)
载体特点: u 使用人U6启动子表达sgRNA序列; u 用Bbs1酶切载体,与crRNA插入片段连接。
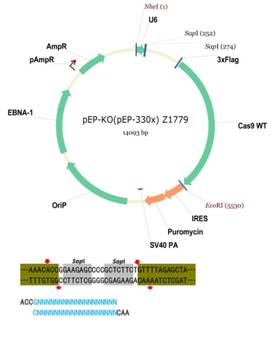
2. 基于EBNA1和oriP的载体 (pEP-KO)
基于EBNA1和oriP元件的非整合型附着体载体(Episomal vector)导入真核细胞后,则以游离体方式转运入核,载体上携带的目的基因能够获得较高水平表达,并随着细胞分裂保持较长时间,但最终会将逐渐去除。
载体特点:
l 使用人U6启动子表达sgRNA序列; l 含有嘌呤霉素(puromycin)抗性筛选基因,可筛选转染后的细胞; l 用Sap1酶切载体,与crRNA片段连接