S-Poly(T)法检测miRNA原理:
S-Poly(T)®法融合了传统的Stem-loop法和Poly(A)加尾法的优点,使用了与miRNA 3`端特异互补的~6个碱基和11个d(T)组成的S-Poly(T)®特异性逆转录引物,在较高温度下(≥42°C)对加尾后的miRNA进行第一链cDNA的合成,不仅显著提高S-Poly(T)逆转录引物与目的miRNA互补结合的特异性和热稳定性,而且逆转录效率更高,从而大幅提高目的miRNA第一链cDNA的合成及后续qPCR效率。qPCR反应使用特异上游引物、通用下游引物和通用荧光探针对miRNA进行检测。示意图如下:
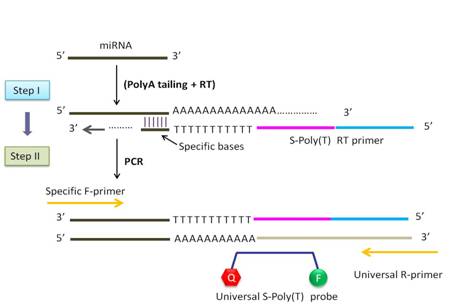
图1. S-Poly(T)法检测miRNA原理图
为什么要选择S-poly(T) plus技术进行miRNA表达谱分析?
ü 一步到位,检出率高
现有绘制miRNA表达谱的主要策略是miRNA芯片和高通量小RNA测序,其结果必须通过qPCR技术的验证;此外,由于灵敏度所限,芯片和测序技术常常出现漏检和误检等情况。用qPCR技术进行miRNA的表达谱分析将大幅提高差异miRNA的检出率和表达的准确性。
ü 引物分组,特异性高
基于S-poly(T)plus原理开发的miRNA qPCR表达谱分析技术是将S-poly(T)引物进行优化性分组,每组包括7个miRNA及1个内参的特异性反转录引物。优化性分组能最大限度提高cDNA合成的特异性,避免引物之间的相互干扰。数据显示,当同时使用20个以上的S-poly(T)引物进行反转录时,部分miRNA检测的灵敏度和特异性会受到一定影响。因此,我们开发的miRNA表达谱分析技术与现有市面上的同类产品相比,具有更高的灵敏性、特异性及性价比。
ü 高灵敏度,能检测特殊样品
由于灵敏度的显著提高,S-poly(T)plus技术特别适合从血清/血浆、尿液、粪便等材料中检测含量甚微的miRNA表达(图13)。Geneup公司也开发了这些材料的RNA提取试剂盒,建立了完整的体液/排泄物miRNA检测方案及服务平台。
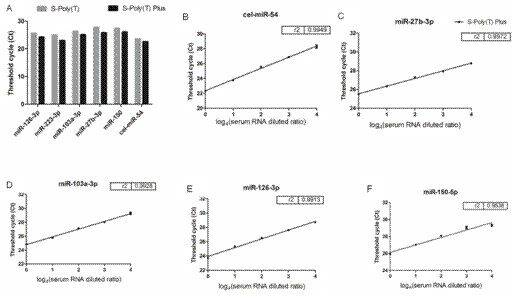
图13. 用S-Poly(T)plus方法检测血清miRNA。(A)比较S-Poly(T)和S-Poly(T)plus检测血清miRNA的灵敏度;(B-F)将血清RNA进行4倍梯度稀释后,用S-Poly(T)plus法检测不同miRNA的表达水平。
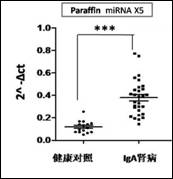
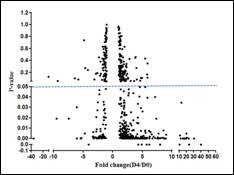
应用实例: (1)组织和细胞miRNA检测 案例1 检测IgA肾病病人血清、尿液、肾组织石蜡切片中的二十多个miRNA表达 样品详细信息: 疾病名称 样本类型 IgA肾病 血清 尿液 石蜡组织 健康人对照 血清 尿液 石蜡组织 结果展示: 图15. miRNA在IgA肾病病人治疗前、治疗后及健康人血清中的表达 图16. miRNA在IgA肾病病人治疗前、治疗后及健康人尿液中的表达 图17. miRNA在IgA肾病及健康人石蜡组织中的表达 (2)特定物种miRNA表达谱检测 案例2 小鼠成肌分化相关miRNA表达谱分析 图18. 小鼠成肌细胞C2C12在分化培养基培养4天后检测720个miRNAs的火山图
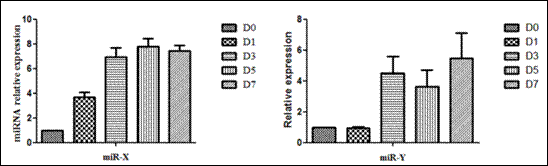
图19. 表达量变化大于4倍的57个miRNAs的表达变化热图(heat map)
图20. 图19中2个miRNAs在C2C12细胞中的表达水平变化
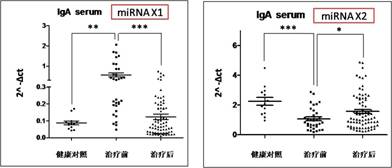
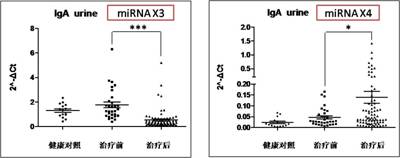

1.miRNA表达谱检测服务
根据用户需求进行特定物种的miRNA表达谱检测。
miRNA表达谱检测(按物种分类)
|
物种及拉丁学名 |
拉丁学名 |
miRNA数量* |
|
人 |
Homo sapiens |
1921 |
|
小鼠 |
Mus musculus |
720 |
|
大鼠 |
Rattus norvegicus |
680 |
|
猪 |
Sus scrofa |
306 |
|
牛 |
Bos taurus |
676 |
|
斑马鱼 |
Danio rerio |
247 |
|
鸡 |
Gallus gallus |
540 |
|
绵羊 |
Ovis aries |
153 |
2. miRNA定制检测服务
可以根据用户需要检测特定的miRNA。
3.miRNA检测服务流程
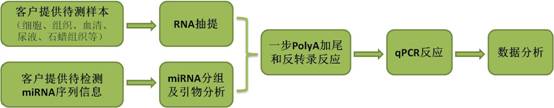
|
实物 |
数据信息 | |
|
客户提供 |
待测样本 |
待测miRNA序列信息 |
|
公司提供 |
剩余样本 |
1) 基本实验步骤; 2) Excel原始数据;3) 数据分析结果 |
